所有接触过基础生物课程的人都熟悉细菌噬菌体(感染细菌的病毒)在现代生物学发展中所起到的作用。作为最简单的生命形态,细菌噬菌体特别易于研究和处理。二十世纪生物学最深刻的见解(如DNA作为基因材料的建立,基因的属性和基因编码,基因转换工作)中大部分都是通过聪明但技术含量低的实验得出的,而这些实验进行都是采用的噬菌体生物学。
这种生物学的本质是:如果给噬菌体提供一个寄主和生长媒介,其数量会在短时间内迅速由几个变为数亿个,且不会对寄主或噬菌体毒性造成任何破坏。大量自然扩增的能力使得噬菌体生长成为今后生物发展过程中一个很好的代中间物质。
噬菌体现在仍是生物科技有用酶的来源,并为生物工程和纳米技术的发展提供了基质。但上一个世纪,随着生物关注点向更复杂水平的转向、富裕国家医学对富贵病治疗的关注,噬菌体对科学和医学的作用被削弱了。像噬菌体自身一样,噬菌体技术发展取决于细菌。当做出细菌疾病可被忽略的决定时,细菌噬菌体也开始被忽略。
细菌性疾病正卷土重来以及在抗生素发展速度缓慢的同时抗生素耐药性正在迅速扩展的情况已不再是什么秘密。随着细菌威胁的加剧,利用更好的工具对细菌进行识别和分类从而给予患者更好治疗的需求也在不断增加[1]。现在开发的噬菌体型细菌诊断能够为医生提供准确、可行信息,而同时还能保持与噬菌体技术相关的低成本、操作简单的特征。
尽可能给予适当抗生素治疗一直都是成功治疗严重性细菌感染疾病的关键[2]。五十年前做到这些是很容易的。但最近美国的一项研究显示:今天患者接受合适抗生素治疗的机会就跟“掷硬币一样”[3]。出现这种现象的原因不难理解:临床上重要细菌的所有菌株几乎至少对一种抗生素有耐药性。
经验治疗(也被称为猜测治疗)将持续导致抗生素的错误选择。选择正确的治疗需要进行抗生素敏感性测试。但目前用来鉴别细菌和检测抗生素敏感性的方法都太慢(通常花费三天才能得出结果)或对资源有限的实验室预算来说费用太高,或者是太复杂(尤其是对那些专家有限的社区医院)。结果是,经常不对患者进行抗生素敏感性测试或直接忽略该测试,因为等到获得检测结果时患者已经好转(或死亡)。
聚合酶链反应(PCR)的分子诊断技术和等温扩增技术在过去十年内已经获得了相当大的进展,而且现在也变得越来越快速、便宜和简单。有充分的理由让我们相信这些趋势将会继续保持。分子技术是或者应该是物种鉴别的金标准。毕竟,该技术是能很好定义微生物种类的一个基因序列。已很好运行的分子检测技术将不可能在速度和物种鉴别准确性方面被超越。
但是,物种种类仅是治疗细菌感染疾病所需诊断信息中的一半(有人辩论说不足一半)。一种有效的治疗很大程度上取决于鉴别感染物质对哪种抗生素敏感。虽然没有物种鉴别的情况下进行有效治疗是有可能的,但只有物种信息的情况对制定有效治疗来说是不足够的。
噬菌体生物学提示了噬菌体适合用于检测细菌抗生素敏感性和耐药性的原因(见图1)。噬菌体是寄生生物,生长和繁殖完全取决于他们细菌寄主。所有能杀死寄主或停止寄主新陈代谢的物质(如抗生素)必定要阻止噬菌体的生长。需要牢记的一点是这种阻止效果是途径或基因独立型。由此噬菌体技术可为检测抗生素敏感性的方法(普遍的或未知的)提供一个基础,且不需要假定潜能的抵抗机制。
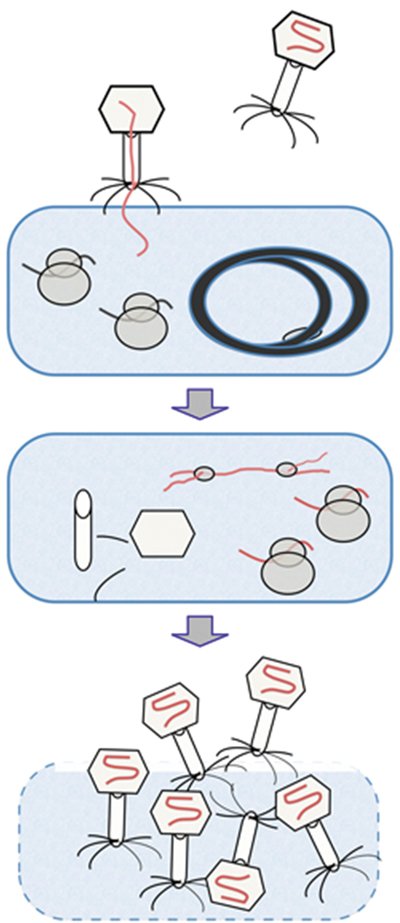
图1
噬菌体生命循环。顶端:细菌噬菌体扫描细菌表面。如果发现适合的受体,噬菌体DNA(或RNA)就会注入。中间:寄主染色体被破坏,核糖体与噬菌体mRNA重组,噬菌体DNA复制开始,且噬菌体蛋白质开始组装。底部:寄主细胞壁退化,释放出成熟的噬菌体颗粒。
然后,大体上,噬菌体技术能够为快速、简单和准确细菌诊断大范围感染性疾病的研发提供一个平台。历史上,已经有两种方法采用噬菌体作为诊断试剂:标记跟踪噬菌体或让噬菌体表达类似荧光素酶的标记物,或检测噬菌体扩增本身[4]。第一种方法有高分析敏感性的优点,带来的是能对单一细胞检测的测试。不过,
仅仅报告初始结合或基因表达的情况会丢失一些特异性。此外,标记步骤也增加了生产制造的复杂性。因为这些因素的存在,噬菌体标记方法没有在商业可获得的检测中施行。
将噬菌体扩增作为细菌存在的一个中间标志物进行检测的方法获得了进一步的发展,本文将会更详细地对其进行描述。已有两种噬菌体型检测获得了商业开发:BioTec
Ltd.用于肺结核(TB)检测的FastPlaque检测和MicroPhage Inc.用于对血液感染物进行检测和分类的MRSA/MSSA 血培养检测。
肺结核诊断
鉴别出结核分枝杆菌感染是细菌诊断面临的最大挑战问题中的一个。样本类型(痰液)也是有名的一个很难处理的问题,阳性样本中细菌的数量可能是很小的,且在五天或更多的双倍时间内,微生物生长地非常慢。富有国家的临床因已经开发了可靠的PCR方法、病例量小且多重耐药性菌株仍相对较少,所以能够处理这些挑战。
问题是诊断资源虽然缺乏,但需求确是很大的。主要限于富有国家大学附属医院的PCR方法对世界其他地区来说是没有用的。毫无疑问,开发资源缺乏临床可用的TB诊断已被盖茨基金会作为其伟大的全球挑战项目的一个首要问题。
BioTec的Fast-Plaque检测是实现开发简单、可用TB诊断目标的有利步骤,表明了噬菌体型诊断的优点和缺点。缺点是由噬菌体必须找到细菌这一事实以及噬菌体和细菌数量必须要足够大造成的。数量大是对诊断试剂来说的。细菌和噬菌体的扩散系数比大分子(如抗体或PCR引物)的扩散系数要慢2-3个等级。
考虑噬菌体结合时间时需要牢记的一个有用数字是:10-9ml/分。一旦乘上检测样本中细菌浓度,该迟钝-探测速率常数就会出现意义,在107个细菌/ml情况下,每分钟大约会感染有1%的细菌。TB和其他一些样本类型问题是:每毫升的样本中的细菌数量可能不超过102。如果噬菌体在相似的浓度下,即使让噬菌体与一个细胞进行结合也将要花费105分钟的时间。
解决速率问题的一个方法是采用高噬菌体浓度驱动结合动力学。例如,108/ml浓度中的噬菌体会在几分钟内感染样本中所有的细胞。但是这种方法制造了一个背景问题,因为100个细胞产生100个后代噬菌体,而每个(总共104个)都将是输入噬菌体水平的一小部分。这个背景问题可采用杀死或排除输入噬菌体的方法解决,具体方法是过滤或增加一种不会杀死内在噬菌体的杀病毒剂[5]。
Fast-Plaque检测采用了后一种方法,利用杀病毒剂处理噬菌体暴露的样本,而其中使用的杀病毒剂要在后代噬菌体产生之前移除(见图2)。仅有几百个噬菌体是由初始噬菌体反应产生的,所以还需要一个扩增步骤来让操作人员进行检测。该检测采用噬菌体自身扩增能力来完成上面这一步骤:将快速成长的分支杆菌物种加入到样本中,然后该分支杆菌在噬菌体检测盘的软琼脂板上迅速扩散。
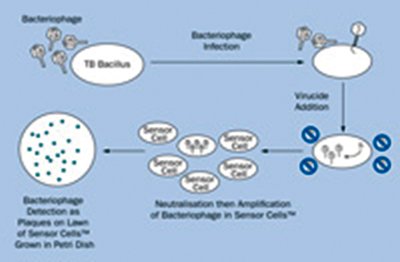
图2 肺结核(TB)检测的
FastPlaque检测。样本中添加分支细菌噬菌体并让其感染所有存在的TB杆菌(上部)。一小时后,在失活过量细菌噬菌体(右侧)内添加杀病毒剂。样本内添加快速生长、非病原性分支杆菌,与熔化琼脂混合,然后涂抹在有盖培养皿上并过夜培养。如果样本中存在TB寄主,会产生后代细菌噬菌体,并以斑块的形式在细菌菌苔上被检测出来。
斑块检测是单一颗粒检测化验中技术含量最低的一个例子。随着寄主细菌的生长和在软琼脂上的渗入,他们将会遇到单一噬菌体颗粒并被其感染。每个感染细胞将会释放出数百个新的噬菌体颗粒,而这些新的颗粒将反过来感染和溶解数百个新的细菌。经过一整夜的培养阶段后,会在细菌菌苔上得到一个大约2-mm的空白处(一个斑块),其中这个斑块通过目视检查就可以很容易地检测出来。
因此,Fast-Plaque检测除高压锅和一个培养器外不需要其他复杂的仪器就可在大约48小时内获得TB检测结果。与噬菌体技术传递有用抗生素敏感性信息的诺言一样,可在基本的ID检测中加入一个检测利福平耐药性和敏感性的平行检测(FastPlaque反应)。
检测的进行需要几个步骤,每个步骤都相当地简单:添加净化液、离心机浓缩和浮层清夜去除、添加细菌噬菌体和孵育物、添加杀病毒剂、添加感应器细胞和媒介、熔化琼脂和盘混合、培养一整夜、计算斑块。
该领域中FastPlaque检测的性能已被联合。设备良好的实验室已经报道了95%或更好的敏感性和特异性[6]。但是,这些敏感性值在某种程度上具有误导作用,因为通常来说仅有70-80%的样本的检测结果是可解释的。检测失败的主要原因是样本中存在的竞争性细菌导致的增生或抑制现象。FastPlaque产物重组后含有抗生素混合物,能抑制非分支杆菌物种的生长,导致可解释的样本数量由70%增加到80%[7]。
资源有限的实验室报道出来的性能差异很大。虽然特异性一般来说都很高(83-100%),但敏感性较差,范围是88%一直下降到21.8%[8]。最可能解释敏感性缺乏原因的是细菌量低。当只考虑未经治疗患者的检测结果时,报道的敏感性是72%或更高。储存和运输期间各种靶向细菌的丢失以及污染也都可能是造成敏感性降低的因素。
整体的观点似乎是FastPlaque最多可与涂片显微镜检查相比较[9]。尽管FastPlaque的特异性比显微镜更好,但其现在的形式还是很复杂的。不过,与涂片显微镜检查相比,扩展后包含利福平敏感性检测在内的FastPlaque检测具有的优点是能提供一个定性结果,而显微镜检查不能评估抗生素的敏感性。随着多药耐药性菌株在许多国家的迅速扩散,能提供定性结果的优点是很重要的,因为其能够在让患者接受最佳治疗的情况下获得很好的抗生素治疗。
及时的金黄色葡萄球菌检测
MicroPhage有限公司(朗蒙特,哥伦比亚)正准备在商业上发布它的首批产品。该产品是一种能够鉴别阳性血培养中金黄色葡萄球菌的检测,并能将这些菌归类为甲氧西林-敏感性或甲氧西林耐药性。MicroPhage平台比FastPlaque检测简单,并为其读取器采用了一种快速检测免疫技术:液体试剂(液体培养基加噬菌体)与干试剂(抗生素)混合、添加临床样本和培养液、检测样本添加到检测器中并读取检测结果(见图3)。
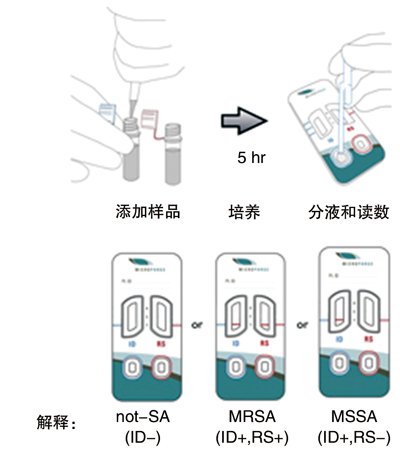
图3
MicroPhage血培养检测的步骤
因为葡萄球菌比分支杆菌增长速度快(倍增时间分别是一个半小时和五天),在单独的一个五小时培养步骤中就会发生噬菌体扩增反应。因快速的检测读取过程,扩增反应结果在20分钟后就可获得而不是要等到一整夜的培养之后才可获得,而且结果也不会受到样本污染失效的影响。这种方法的优点是将微生物学检测转换为所有实验室人员都能可靠操作的简单的免疫检测,其中微生物学检测方法通常需要操作人员具有较高的知识和经验水平。
葡萄球菌菌血症检测是噬菌体扩增技术特异性的一个关键检测。细菌噬菌体占据了许多生态区位。多面性噬菌体能感染很大范围的细菌种类,但在所有特殊的物种中只能适度扩增。专一性噬菌体善于对一种或几种细菌种类进行感染。很明显,细菌鉴别检测应该充分利用第二类噬菌体。但在临床检测中利用细菌噬菌体获得的特异性水平仍是一个没有答案的问题。就这一点而言,菌血症扩增是一个特别的挑战性应用。阳性血培养中普遍存在的、密切相关性非致病性葡萄球菌物种数量是金黄色葡萄球菌数量的三倍[10]。
MicroPhage
MRSA/MSSA血培养检测的一个多中心临床试验已于2010年1月完成并正在接受FDA的审查。结果表明细菌噬菌体技术确实能够带来较高的诊断特异性(见表1)。此外,噬菌体检测还能够将金黄色葡萄球菌菌株归类为甲氧西林-敏感性或甲氧西林-耐药性,且该检测的准确性接近参考方法。
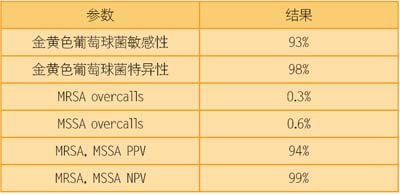
表1
多中心试验中MicroPhage血培养检测的性能。总的样本检测数=1116,总的金黄色葡萄球菌样本=366。样本:10μL阳性血培养。
参考方法:试管凝固酶和细菌ID葡萄球菌;抗生素敏感性头孢西丁磁盘扩散。
因为该检测可在短暂时间内获得结果,所以其有提高金黄色葡萄球菌血液感染检测的潜能。其中金黄色葡萄球菌血液感染病有很高的致死率(死亡率大于20%),通常因为无法选择合适的抗生素治疗而导致患者不能接受治疗或接受错误的治疗[11]。金黄色葡萄球菌感染引起了一系列其他重要的健康医疗问题。MicroPhage正在计划将其金黄色葡萄球菌检测扩展为包括创伤和手术部位感染、肺炎检测以及鼻腔筛查检测在内的检测。
管理体制和实施障碍
细菌噬菌体技术已经作为I级IVD在FDA中出现一些先例,噬菌体检测注册是CDC和US部队采用λ-噬菌体分别为葡萄球菌sp噬菌体分型项目和B炭疽芽孢杆菌(炭疽热)检测所做的。在II级IVD中采用噬菌体扩增的MicroPhage应用将可能使同领域的其他单位获益,因为这些单位可以将其作为他们向FDA递交申请书的一个预测设备。
采用噬菌体技术(尤其是细菌噬菌体扩增)会面临很少的障碍,因为在该平台上进行的首次检测已经表现出了与其他标准方法相同的性能。临床微生物学家作为该平台的主要终端用户熟悉细菌噬菌体,而且知道这些细菌是I级生物研究安全性有机体,不会对检测人员造成任何不应有的风险。
还未建立当前为细菌噬菌体技术指定的赔偿制度。MicroPhage计划继续采用标准方法来证明检测性能和经济收益,并通过与分子方法比较来建立一个新的CPT编码。MicroPhage阶段报告中也计划在申请新的编码和定价方法的同时采用其他各种编码。
未来发展
噬菌体诊断技术的成长和发展可通过评估他们与竞争性技术相比存在的优点与缺点来进行预测。细菌诊断中的大多数技术发展都是以核酸检测(NAT)技术为基础,典型的代表是PCR和等温扩增方法。表2概括了细菌噬菌体扩增技术与NATs技术在细菌诊断中的主要不同之处。
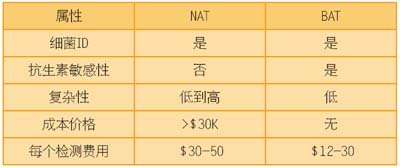
表2 核酸和细菌噬菌体扩增技术对比
复杂性一直是发展NATs中的一个约束因素。各种样本类型中都发现了DNA聚合酶的抑制剂,从而需要采取昂贵的样本处理步骤,结果是导致成本和复杂性之间的权衡。自动化样本制备仪器降低了复杂性和人工处理时间,但却增加了资本成本。相反,细菌噬菌体已经进化为在细胞外生物学条件下工作,一般来说对样本的干扰因素不敏感。例如,FastPlaque检测仅仅需要对痰液样本进行净化和离心处理,而MRSA/MSSA血培养检测不需要进行样本制备这一过程。
虽然NATs在鉴别细菌种类这方面很好,但他们准确测定抵抗性和敏感性的成功次数很有限。限制因素看起来不是技术本身的原因,而是基本的生物学上的原因。NAT方法在测定金黄色葡萄球菌中甲氧西林耐药性方面一直很成功,但MRSA很可能是NATs的低成本产物。耐药性菌株范围的广泛性使得特异性、保存良好的基因盒(sccMec)出现,其中基因盒能融入到金黄色葡萄球菌染色体中的一个独特基点位置上。耐药因素在物理上与鉴定金黄色葡萄球菌的染色体联系在一起是不常见的。大多数的耐药因素都是在杂乱地穿梭于物种之间的质粒中发现的,且在质粒穿梭通道内获得大量的基因重组和位点突变。这些重组使设计通用引物设置的努力变得毫无意义。而且,耐药质粒也可能会在非病原性有机体内发现,从而引发了混合感染中出现假性耐药结果。
这种生物学带来的结果是NAT诊断主要集中于物种的鉴定上。虽然物种鉴定对诊断病毒感染有一定的价值,但其对细菌感染的诊断价值很小,细菌感染诊断需要利用额外的抗生素敏感性信息来指导治疗。
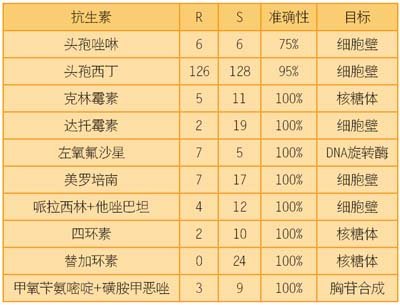
表3
金黄色葡萄球菌抗生素敏感性检测。R=耐药菌株数量,S=被测敏感菌株数量。
血培养中检测的所有菌株。
敏感性测试的金标准将可能继续建立在培养方法基础上。细菌噬菌体扩增是一种采用中间标志物促进培养结果的方法。MicroPhage的概念验证实验说明了噬菌体技术创建新的抗生素敏感性检测的能力。鉴定出了对八种抗生素中的一种或更多种有耐药性的金黄色葡萄球菌临床隔离群嵌板,并采用噬菌体技术检测了敏感性测试(见表3)。检测的抗生素包括所有主要类别,有DNA综合体抑制剂、蛋白质合成体和细胞壁合成体。噬菌体检测能够准确地给出所有抗生素目录中的敏感性和耐药性。尽管还在初步阶段,该实验支持以下命题:噬菌体技术可为细菌诊断学的发展提供一个综合平台。
细菌噬菌体技术是一个生物学方法,可与商业化培养方法相比对,主要是类似ChromAgar和MRSA选择的生色媒介以及类似Vitek和Phoenix的自动化ID/AST系统。像容易操作的ID/AST系统一样,噬菌体检测(假设可接受性性能)能够测定抗生素敏感性并指导医生对患者进行治疗。噬菌体技术在这方面的优点有:可直接对样本进行检测,从而让报告结果在数小时内可获得而不是要经过2-3天的时间。对于像血液感染和肺炎的重要适应症来说,这种获得结果的时间差异可能有重要的临床价值。
噬菌体检测和生色媒介仅仅需要一个培养器,且两者目前均只报告一种物种。他们与自动化系统不同之处在于成本价格非常低,可让更多的机构使用。但是他们不能提供一份有关物种和抗生素敏感性的综合报告。生色媒介目前只用于对细菌种类和耐药菌株进行假定鉴别,一般需要18-24小时,且利用一个改进前步骤会获得最佳效果。
因为所有的细菌都有细菌噬菌体,所以噬菌体技术可被扩展到包含整个病原性细菌库,至关重要的是提供抗生素敏感性的及时检测结果。随着该技术的成熟,检测将变得更加合理化,且有可能随着扩展的目标细菌和抗生素加入到控制板中。该检测实现自动化没有很大的障碍,所以可能实现仪器某些功能的自动化,如呼叫、记录以及将检测结果传递到临床信息系统的过程。另一项潜能的进展区域可能是临床、急诊中心和长期护理设施中床旁检测的发展。因为这些检测仅需要一台培养器,所以带有一个小加热组件的新型试剂盒可被接受培训很少的人使用。
细菌噬菌体一直以来都是科学界的朋友,促进了细胞工作方面的很多发现。噬菌体技术现在将变为临床的朋友,使他们能更快、更好、低成本对严重细菌感染疾病进行诊断。
摘自:www.IVD Technology.com
编译:柏芳
(版权归原作者所有,本文仅供内部学习使用)
参考文献
1. Carroll, “Rapid Diagnostics for Methicillin-Resistant Staphylococcus
Aureus: Current Status,” Molecular Diagnosis & Therapy 12, no. 1 (2008):
15-24.
2. Fagon and Chastre, “Antimicrobial Treatment of Hospital-Acquired
Pneumonia,” Clinics in Chest Medicine 26, no. 1 (2005): 97-104.
3. Herzke, et al., “Empirical Antimicrobial Therapy for Bloodstream
Infection Due to Methicillin-Resistant Staphylococcus Aureus: No Better than
a Coin Toss,” Infection Control Hospital Epidemiology 30, no. 11 (2009):
1057-1061.
4. Loessner, et al., “Construction of Luciferase Reporter Bacteriophage
A511::luxAB for Rapid and Sensitive Detection of Viable Listeria Cells,”
Applied and Environmental Microbiology 62, no. 4 (1996): 1133-1140.
5. Rees, et al., “Methods for Rapid Microbial Detection,” US Patent
5,498,525.
6. Albert, et al., “Evaluation of a Rapid Screening Test for Rifampicin
Resistance in Retreatment Tuberculosis Patients in the Eastern Cape,” South
African Medical Journal 97, no. 9 (2007): 858-863.
7. Mole, et al., “Improved Contamination Control for a Rapid Phage-Based
Rifampicin Resistance Test for Mycobacterium Tuberculosis,” Journal of
Medical Microbiology 56 (2007): 1334-1339.
8. Kalantri, et al. “Bacteriophage-based Tests for the Detection of
Mycobacterium Tuberculosis in Clinical Specimens: a Systematic Review and
Meta Analysis,” BMC Infectious Diseases 5, no. 1 (2005): 59.
9. Biswas, et al., “Evaluation of the Usefulness of Phage Amplification
Technology in the Diagnosis of Patients with Paucibacillary Tuberculosis,”
Indian Journal of Medical Microbiology 26, no. 1 (2008): 75-78
10. Karlowsky, et al., “Prevalence and Antimicrobial Susceptibilities of
Bacteria Isolated from Blood Cultures of Hospitalized Patients in the United
States in 2002,” Annals of Clinical Microbiology and Antimicrobials 3
(2004): 7.
11. Uçkay, et al., “Management of Gram Positive Bacteraemia,” Current
Opinion in Infectious Diseases 20, no. 6 (2007): 561-567.