注册登录才能更好的浏览或提问。
您需要 登录 才可以下载或查看,没有账号?立即注册
×
黄雅萍,吕时铭
免疫因素所致的不孕不育,临床表现不具明显特征,常靠实验诊断明确病因,血清、宫颈粘液中的与生殖有关的自身抗体检测是常用的诊断免疫性不孕的手段。免疫功能失调或感染、外伤等因素可破坏屏障导致封闭抗原暴露,使自身抗体产生,引起超出正常限度的免疫反应。自身抗体可因破坏内分泌、排卵、受精、着床等环节而导致不孕。因而抗精子抗体、抗子宫内膜抗体,抗心磷脂抗体,抗卵巢抗体等同种免疫或自身免疫抗体的检测,可作为免疫性不孕不育患者必要的检测项目。
一、抗精子抗体的检验诊断
在男性,抗精子抗体(antisperm antibody, AsAb)属于自身抗体,它通过影响精液的质量而降低生育能力。在女性,抗精子抗体属于同种异体抗体,是女性免疫性不孕的重要原因。
(一)男性抗精子抗体的产生
正常情况下,男子体内的血—睾丸屏障可使精子与免疫系统隔离。当此屏障因生殖系统局部炎症(睾丸炎、附睾炎、前列腺炎、尿道炎)、膀胱结石或肿瘤等疾病、创伤(外伤、输卵管结扎术后)而受损,或男子精浆中免疫抑制因子减少时,精子或其可溶性抗原就可能渗漏到外围组织,一旦精子或其可溶性抗原进入血液或与免疫系统接触,便成为抗原而刺激机体对精子的免疫反应,产生自身免疫抗精子抗体。
(二)女性抗精子抗体的产生
精液内含有多种蛋白可作为抗原,精子抗原对女性而言属同种异体抗原。虽然阴道和宫颈上皮具有对抗原物质的吸收力,在性交时有少量的精液可被吸收,但在正常情况下,并不使女性对其配偶的精子抗原产生抗精子的免疫反应。其原因是:
1.精子膜不表达经典MHC-I类抗原,在缺乏MHC-I类抗原情况下,即便引发免疫反应,也为抑制性免疫反应。
2.阴道上皮是复层鳞状上皮,可有效阻止精子穿过上皮进入血液引起致敏。
3.精浆中存在抑制精子抗原表达的免疫抑制物质,这种高效的免疫抑制物质附着在精子表面可以遮蔽或改变精子的抗原决定簇,以及干扰女性免疫活性细胞的反应能力和对精子抗原的识别。
4.性交后,精子进入生殖道,有小部分快速运动的精子可能几分钟到达输卵管,这些精子不参加受精,然而可能由于精子表面携带着精浆等免疫因子,可能为后几小时到达的精子铺出一条道路,避免激活局部免疫系统。
5.女性体内存在着独特型抗体和抗独特型抗体之网络,控制着体内免疫反应。即当一种抗原引发免疫反应后,新的抗体则成为宿主的新的抗原,刺激宿主产生第二抗体,第二抗体反过来使原先抗原衰减并得以控制。
6.正常女性生殖道也具有酶系统,能降解进入的精子抗原,使其不能到达免疫系统。
但是,一旦上述环节发生异常或者精子接触有粘膜损伤的女性生殖道,便可能使女性产生抗精子抗体。主要与以下因素有关:
1.女性体内存在的独特型抗体和抗独特型抗体的网络功能紊乱,使精子抗体不断产生、增加,以致造成免疫不孕。造成这种网络功能紊乱的原因可能有遗传上固有的缺陷。
2.女性生殖道的酶系统缺陷,使抗精子抗体保持完整而刺激同种抗精子抗体的产生。
3.对精子过敏和感染有关,女方对丈夫精子过敏,可能与免疫反应存在个体差异有关,也可能因丈夫精液中缺乏能抑制女性对精子产生同种免疫反应的免疫抑制因子所致。
4.生殖道病毒和细菌感染,微生物感染可起到一种外来抗原激发抗精子抗体的反应。这可能是由于感染使局部的非特异免疫反应加强,近年发现某些细菌表面抗原(肺炎杆菌、绿脓杆菌等)与精子抗原相同,发生交叉反应,感染后产生抗精子抗体。
5.生殖道创伤及炎症有关的生理屏障的破坏,如妇女在月经期、有异常出血、人流吸宫术后或患有生殖道感染时进行性活动,导致精子抗原通过女性生殖道破损的粘膜上皮吸收增加,大量广泛进入皮下的B淋巴细胞及血液循环,使精子抗原直接与免疫系统接触,激起女性对精子发生免疫反应的一系列作用,包括刺激生殖道的巨噬细胞吞噬精子、限制精子穿越生殖道的能力、造成精子膜损伤和精细胞溶解等,继而在女方血液中或生殖道局部产生抗体。这种抗体对精子具有凝集或制动作用,特别是女性生殖道局部的抗精子抗体对精子影响更大。
一旦精液抗原致敏后,正常性交时的少量抗原即可导致机体产生大量的抗体,即所谓“二次免疫反应”。
(三)抗精子抗体的分类
1.根据抗体存在的部位:循环抗体,局部抗体。
2.根据球蛋白类型:IgG、 IgM、IgA。
3.根据作用部位:头部、顶体、体部、尾部。
4.根据抗原性质:不同的精子抗原成分产生相应的不同抗体,主要有以下几种。
(1)精子特异抗原:7种抗原:3种特异,4种精浆交叉抗原;
(2)精子膜抗原(sperm coating antigen SCA)来自精囊液;
(3)精子酶:LDHx透明质酸酶;
(4)组织交叉抗原:精子表面有脑、肾上腺、甲状腺等组织的交叉抗原;
(5)血型抗原:A、B血型抗原;
(6)组织相容性抗原 HLA-A、HLA-OR-H-Y抗原;
(7)细菌交叉抗原。
(四)抗体导致不孕的机制
附于精子表面的抗体为IgA或IgG,精子尾部结合抗体多为IgG,精子头部结合抗体多为IgM。抗体可影响受精过程的各个环节并影响到受精后卵子,如抗精子头部的抗体可干扰精子获能与顶体反应,影响精子的运动;抗精子尾干的抗体抑制精子活动;抗精子抗体的Fc段与宫颈粘蛋白结合,可干扰精子穿过排卵期宫颈粘液;细胞毒性抗精子抗体在补体参与下使精子细胞膜损伤,致使精子死亡;抗精子抗体的调理作用可促进生殖道局部吞噬;抗精子头部的抗体还能阻断精卵结合,引起补体介导的受精卵的溶解,损害胚胎植入及前期胚胎发育导致早期流产。
(五)抗精子抗体的检验诊断
检测
抗精子抗体因检测方法不同,结果也不尽相同。通常不育症患者血清中抗精子抗体检出率为20%~30%,而在梗阻性无精症病人中,抗精子抗体阳性率则可高达60%。不育症患者血清中抗精子抗体通常以IgG、IgM为主,而精浆中以IgG、IgA出现较多。鉴于抗精子抗体的异质性以及其中很多抗精子抗体针对的靶抗原与生育并不相关,因此,对抗精子抗体的阳性结果必须结合临床加以考虑。
1.性交后试验 通过测定宫颈粘液中活动精子数,借以评价性交后若干小时内精子存活及穿透功能的试验。该项试验常在女性排卵期内进行,试验前要求3天以上未排精,于性交后6~24h内取阴道后穹窿、宫颈口、宫颈管内的粘液标本,在高倍镜下观察计数精子数。在宫颈口黏液涂片的每高倍视野中,有≥21个活动力良好的精子者为好,有6~20个活动力良好的精子为良好,有1~5条活动精子属尚好,如果每视野下精子数少于5个,特别是活力不好,提示宫颈粘液有异常或精子活力低下。本实验受测试夫妇心理和情绪情况及宫颈粘液中的理化特征等非免疫性因素的影响,可作为检测生殖道局部抗精子抗体的初筛手段。
2.宫颈粘液抗精子抗体的检测 宫颈及子宫内膜的免疫组化研究发现,其粘膜内有产生IgG、IgA的淋巴样细胞,且已证实宫颈黏液内含有抗精子的IgG、IgA、IgM。Etribi对不明原因的不孕夫妇检测发现,血清抗精子抗体的阳性率(40%)明显低于宫颈黏液阳性率(55%)。女性生殖道局部抗体可能是原因不明的不孕者的主要原因之一。
由于宫颈黏液具有一定的稠度,所以难以用测定血清抗精子抗体的方法测定宫颈黏液抗精子抗体,通常使用的方法有精子—宫颈黏液接触试验、交叉试验、宫颈黏液穿透力试验等。
(1)精子-宫颈黏液接触试验 是将精液与排卵前宫颈黏液混合孵育,镜下观察精子震颤现象,>50%为阳性,提示可能有局部抗精子抗体存在。见图1
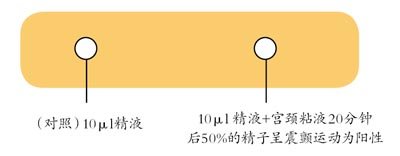
图1 精子—宫颈粘液接触试验(SCMCT)(SCMCT)
(2)宫颈黏液穿透力试验 宫颈粘液装入毛细管,一端密封,另一端浸入精液储存瓶内,37℃保温后,镜下观察5个以上活精子到达的最远距离,<20mm为穿透不良,>20mm为穿透良好。本试验可受非免疫因素影响,如精子的活力、宫颈黏液的理化性质等。
3.精子—透明带结合或穿透试验:自腹腔镜检查中获得的人卵与精子在一定条件下孵育后,观察精子能否穿过透明带进入细胞周围的空间,若精子不能穿过透明带,考虑有制动抗体存在,此试验亦受其它因素干扰。
4.精子—去透明带仓鼠卵穿透试验(SPA):将优化提取的的活精子与无透明带仓鼠卵混合孵育,在相差显微镜下观察,若卵内含肿胀精子头(带尾)为已经穿透。SPA可用于判定:①有精浆抗体的精子的受精能力;②各种抗体在阻止受孕时的重要性。此试验也可受多种因素影响。
5.凝集试验 精子抗原与抗体结合后可发生凝集反应,凝集反应是抗原与特异性抗体反应的传统及敏感的方法,通过肉眼或显微镜观察结果。在抗精子抗体的检测中,常用凝集反应,结果可靠,成本低。检测方法包括:明胶凝集试验 、玻片凝集试验、浅盘凝集试验。这些试验检测的免疫球蛋白类型为IgG、IgM。方法是以正常人精子作检测指示,在倍比稀释的被检血清(或宫颈黏液)中,加入适量的正常人精子,37oC孵育后,在光镜下观察。
精子被凝集后,光镜下呈现五种凝集方式:头对头凝集,头对尾凝集,尾对尾凝集,尾尖对尾尖凝集,混合型。凝集试验效价低于1:16时,有可能存在非特异因素,但多为头对头凝集,其他凝集类型多为抗精子抗体引起。
(1)明胶凝集试验(GAT):适当稀释的精子悬液与10%明胶溶液混合后加入待测血清孵育,2h后若出现絮状物为阳性。此法简便,特异性强,易检测男子抗体介导的尾对尾精子凝集,每次设阴性及阳性对照组,则结果较可靠。
(2)试管玻片凝集试验(TSAT):按要求稀释的精子悬液与待测血清孵育2~4h后镜下观察,≥10%凝集为阳性。此法最易检测头对头精子凝集,主要用于分析女性血清,方法简便,但可受多种因素干扰,如微生物、组织碎片、血中雄激素升高,均可发生非特异性凝集。每次试验应设对照组。
(3)浅盘凝集试验(TAT):浅盘凝集试验可观察各种精子凝集类型,试剂用量少。使用特制浅盘,只需检测样本几微升,在倒置显微镜下观察,≥10%凝集为阳性。此法所用样本较少,可同时检测较多的血清样本,敏感性比上两法高,亦少受非特异性因素干扰。若血清效价≥1:32,则可认为确含精子抗体。
6.精子制动试验和细胞毒试验 精子抗体与精子表面抗原相互作用,激活补体系统,从而产生对精子细胞膜的通透性和完整性的损伤作用。若为制动抗体,使精子失去活力,制动值≥2为阳性;若为细胞毒抗体,则导致精子死亡,用某些染料染色阳性,要求精子活率>70%。微量法仅需样本几微升,对精子活动率较低的样本,可用上游法提取活精子,活率可达90%以上。本法仅能检测作用于精子尾干的抗体,特异性强,敏感性差,假阴性率较高。精子制动试验阳性者的妊娠率明显低于精子凝集试验阳性者。
7.被动血凝法 用精子提取物及精浆包被经处理的红细胞使之致敏,将致敏红细胞与待测稀释血清在微量反应板上进行反应,出现红细胞凝集为阳性。此法不受精子活率、计数、精液中微生物或组织碎片的影响,研究者认为此法特异、敏感,但报道较少,其可靠性及实用性尚待证实。
8.间接免疫荧光试验 血清中(宫颈黏液)的抗精子抗体与精子表面的抗原结合后,能与标有荧光素的抗人免疫球蛋白抗体(第二抗体)结合,可使精子膜显示荧光。在荧光显微镜下观察呈现荧光的阳性精子比例。因试验中需要甲醇固定,致精子膜损伤,内部抗原外露,而抗内部抗原的抗体在正常人中普遍存在,故假阳性多,无临床实用价值。近年来,作液相培养,实验过程中无需固定,又重新确定了本法的使用价值。 此法灵敏度高,可作抗原定位,但重复性差。
9.酶联免疫吸附试验(ELISA)及生物素—亲合素酶联免疫吸附法(BA-ELISA)应用完整精子或精子膜抗原包被固相载体,待测样本中精子抗体与之培养后结合,随之加入的酶标第二抗体与精子抗体结合,根据酶底物显色,显色深浅与抗精子抗体的量成正比,用酶标仪测定后判断结果。结果客观、准确。由于完整精子包被易致非特异性吸附,因此若以可溶性精子膜抗原包被,则本法敏感、特异、客观、定量,能确定抗体类型,且易操作。BA-ELISA是在常规ELISA基础上发展起来的新一代定量检测法,其敏感法性、特异性超过常规法。但很难购到较理想的试剂盒,通常试剂盒难尽人意,结果不太稳定,假阳性太多。
10.免疫珠试验(Immuno bead test,IBT) 利用兔抗人免疫球蛋白抗体(抗IgG-IB,抗IgA-IB,抗IgM-IB)包被的聚丙烯酰胺微珠能结合于结合了精子表面的精子抗体,在相差显微镜或电子显微镜下可见到免疫珠随精子运行,若结合一个或多个免疫珠的精子比例≥10%,为阳性。此法可确定抗体的部位、类型及结合精子的比例,能测出活精子表面结合的抗体。其敏感性、特异性及重复性较好,操作稍繁琐,检测所需样本少,可用于宫颈黏液、输卵管液等微量样本的检测。也有的兔抗人免疫珠,呈不同颜色的抗精子头部、顶体、体部、尾部抗体的免疫珠,便于检测抗体对精子的作用部位。
11.放射性标记免疫球蛋白或A蛋白法 同位素标记的抗人免疫球蛋白或葡萄球菌A蛋白与结合在精子表面的精子抗体结合,用γ-计数器测定精子表面的放射活性。若以活精子作为抗原其特异性及敏感性较高,且可确定抗体类型。但由于每次实验活动精子来源不同,其结果重复性较差;且设备昂贵,操作者易受放射性损害,故此法报道较少。
12.ABC免疫组化法 精子经固定后与待查抗体作用,加入生物素化羊抗人IgG(第二抗体),再加入预选使亲和素与酶标记生物素,按一定比例共温形成的亲和素-生物素-过氧化酶复合物(ABC)反应,最后在底物中显色。
13.蛋白质印迹法 将粗提人精子膜抗原进行SDS-PAGE电泳,然后将膜抗原从凝胶上转移到醋酸纤维膜上进行转移电泳,在电场作用下,蛋白质进入醋酸纤维素薄膜而固相化,随后与待检标本(第一抗体)温育,再与结合有辣根过氧化酶的兔抗人IgG(第二抗体)温育洗涤后,加入酶底物显色处理,其醋纤膜经扫描分析,即可检测抗精子抗体量。本法可检出微量或极微量低效价的抗精子抗体,尤其适合体外授精系统检测抗精子抗体量,并可分析抗精子抗体在精卵结合中的生物学活性,有助于从分子水平研究免疫性不孕不育的机制。
二、抗子宫内膜抗体及其检验诊断
女性体内的抗精子抗体属于同种异体抗体,而抗子宫内膜抗体(anti endometria antibody, EMAb)则是一种以子宫内膜(endometrial)为靶细胞并引起一系列免疫病理反应的自身抗体。抗子宫内膜抗体往往与子宫内膜异位症并存,是子宫内膜异位症的标志性抗体。目前,二者对不孕不育的影响程度及其作用机制尚无定论。
(一)抗子宫内膜抗体的产生
子宫内膜是胚胎着床和生长发育之地,育龄妇女子宫内膜在卵巢激素的调节下,产生周期性的剥脱,随月经流出体外,一般不诱发机体产生自身免疫反应。但当某些病理状态下,如机体免疫环境失调、子宫内膜异位症患者受到异位内膜的刺激、经血倒流等因素导致免疫应答紊乱或人工流产刮宫时损伤和炎症,使巨噬细胞吞噬子宫内膜碎屑,处理提呈给T、B淋巴细胞,引起淋巴细胞活化,产生抗子宫内摸抗体。
(二)抗子宫内膜抗体导致不孕的机制
抗子宫内膜抗体的靶抗原主要存在于子宫内膜腺上皮细胞的胞质中,是一种孕激素依赖性糖蛋白,分子量为26KD~40KD,富含于分泌期子宫内膜中。当抗子宫内膜抗体与子宫内膜上的靶抗原结合时,可沉积于子宫内膜和异位的病灶中,激活补体系统,引起子宫内膜的免疫病理损伤。电镜下可见子宫内膜发育不良,内膜腺体和基膜出现空泡,纤毛与非纤毛细胞比值降低,子宫内膜呈现分泌不足,从而影响孕卵着床,出现不孕或流产。抗子宫内膜抗体的产生有可能①干扰胚胎着床;②抑制排卵;③干扰精子和卵子的运送;④阻碍精卵结合;⑤影响早期胚胎的发育。
(三)抗子宫内膜抗体的检验诊断
目前最常用的方法为酶联免疫吸附试验与金标免疫斑点法,也有用放射免疫分析法等的。不仅有测定循环血中的抗体,也有测定宫颈局部的抗体的。血循环抗子宫内膜抗体测定:标本为静脉血2ml,常规分离血清,采用市售ELISA试剂盒,也有人测定宫颈局部的抗子宫内膜抗体,采集月经中期的宫颈分泌物,用5倍生理盐水稀释,离心后测定上清液中的抗子宫内膜抗体。
三、抗透明带抗体及检验诊断
卵透明带是被覆于卵母细胞及着床前受精卵外的一层基质,由糖蛋白组成。在受精过程中及早期孕卵发育方面具有重要的作用。
(一)抗透明带抗体的作用
研究表明,透明带抗原可诱发同种或异种免疫反应,产生抗透明带抗体,抗透明带抗体可以阻止精子穿过透明带与卵子的结合,从而干扰受精及着床,造成不孕;抗原抗体复合物的沉积还可抑制卵巢功能,导致卵巢衰竭表现为垂体促性腺激素水平升高、卵母细胞数减少、卵泡发育失常、闭锁、黄体功能不全等。抗透明带抗体的检测可作为不孕不育、卵巢功能早衰的辅助诊断。
(二)抗透明带免疫性不孕症的检测
人卵透明带来源有限,很难获取,但人卵透明带与猪卵透明带间有交叉抗原性,因此实际工作均用猪卵透明带代替人卵透明带用于检测人血清中透明带抗体。由于部分正常人血清中存在异种凝集素(主要为IgM)干扰实验结果,因此检测前需用新鲜猪红细胞处理待测血清。
1.ELISA及BA-ELISA法 以猪卵透明带抗原包被固相载体,另加待测血清、酶标第二抗体及底物,分步培养洗涤,最后根据底物颜色变化情况判断结果。本法所需样本量少,操作简便,能定量测定抗体并确定抗体类型,特异性及敏感性较好。BA-ELISA具有常规ELISA的优点,而其敏感性大为提高。
2.精子—透明带结合或穿透试验 若存在透明带抗体或抗精子抗体,此法均可阳性。由于试验受培养环境因素影响较大,故对不同实验室的研究结果难以比较。此法可与其它方法配合应用,相互补充,以保证结果的可靠性。
3.放射免疫法 用放射性核素标记的猪卵透明带抗原与待血清培养后,分离出抗原抗体复合物,测定其放射性。本法可定量,特异性及敏感性较好,但由于放射性损害,且报道不多,其应用价值尚难肯定。
4.间接免疫荧光试验 人抗透明带抗体结合至猪卵表面后,标有荧光素的抗人免疫球蛋白抗体随之结合至透明带表面,在荧光显微镜下呈现明显的卵周荧光。本法的可靠性有赖于其它客观方法证实。
5.被动血凝法 用纯化的猪透明带抗原包被其他物种的红细胞为抗原靶标,在存在透明带抗体的情况下,致敏红细胞发生凝集。此法研究报道较少,难以评价其敏感性和特异性。
6.透明带沉淀反应 透明带表面结合抗体后,在光镜或暗视野显微镜下呈现折光改变。本法多用于鉴定血清,敏感性较低,难用于临床。
四、抗卵巢抗体及其检验诊断
卵巢有生殖和内分泌功能,神经内分泌系统对之有调节作用。而免疫功能异常可直接或间接地影响卵泡生长、发育和成熟,使卵巢性激素分泌异常,临床可有月经紊乱,诱发闭经不孕等改变。
卵巢组织中抗原成分复杂,正常机体具有自身免疫调节功能,能产生极弱的抗体,帮助清除体内衰老变性的自身成分。一旦由于感染、手术等原因使其抗原异常表达,导致免疫系统对自身组织产生过度免疫应答,则会发生过强的体液免疫和细胞免疫反应,所涉及的组织免疫活性细胞数量增多,导致抗卵巢抗体(antiovarian antibody,AoAb)产生。抗卵巢抗体是一种靶抗原,是存在于卵巢颗粒细胞、卵母细胞、黄体细胞和间质细胞内的自身抗体。抗卵巢抗体与抗原结合形成的抗原抗体免疫反应可以引起卵巢免疫损伤,影响卵巢的正常发育和功能,并可导致卵巢衰竭或卵泡成熟前闭锁,卵子退化和妨碍细胞分裂,产生抗生育效应。因此,抗卵巢抗体也是女性不孕的主要免疫因素。
随着免疫学的发展,将患者卵巢组织作为抗原而引起的自身免疫反应定义为自身免疫性卵巢炎。自身免疫性卵巢炎是自身免疫性不孕、卵巢早衰等疾病的重要原因之一,为机体体液免疫反应过强导致卵巢卵泡发育障碍、内分泌紊乱。临床表现为患者年龄小于40 岁,而闭经、血FSH、LH升高,外周血测得抗卵巢抗体。一些自身免疫性疾病如Adison病,甲状腺炎患者体内有抗卵巢抗体存在。
五、抗心磷脂抗体及其检验诊断
抗心磷脂抗体(anticardiolipin antibody,ACA)主要于组织炎症、损伤及粘连后产生。带负电荷的磷脂如心磷脂是细胞膜的组成部分,抗心磷脂抗体可与之结合而产生一系列不良反应。动物实验证实抗心磷脂抗体可致受孕率降低,胚胎死亡率增高,与不育和流产关系密切。
抗心磷脂抗体导致不孕的机制,主要是抗心磷脂抗体影响母体免疫系统的许多生殖过程。通过阻断磷脂代谢,导致花生四烯酸的释放受阻,从而干扰前列环素(PGI2)的产生,影响正常受精过程。抗心磷脂抗体使前列环素受到抑制,降低C反应蛋白活性、抑制抗凝血酶Ⅳ的形成、改变血小板和血管内皮的关系,小血管内有血栓形成倾向,而引起着床部位供血减少,或导致蜕膜或胎盘血流不足而发生病变。同时抗心磷脂抗体可影响细胞内第二信使的产生,改变受体后偶联及信号传导过程,导致胚胎内外环境物质及交换异常,从而影响胚胎的发育,导致早期胚胎丢失反复流产、不孕。病理也证实抗心磷脂抗体阳性者其胎盘的滋养细胞胞浆和绒毛血管壁出现免疫复合物沉积。临床上发现抗心磷脂抗体还与宫内发育迟缓有密切关系。
六、抗绒毛膜促性腺激素抗体及其检验诊断
绒毛膜促性腺激素(human chorionic gonadotropin ,hCG)是合体细胞滋养层分泌的妊娠特有激素,其主要功能是维持妊娠黄体及促使甾体激素分泌。此外,hCG还可防止胎儿被母体血液中的抗体及免疫活性细胞识别,故对维持早期妊娠,对抗母体对胎儿的排斥起关键作用。人绒毛膜促性腺激素是维持早期妊娠的主要激素,但是有自然流产史的女性在流产过程中,绒毛膜组织中的hCG可能作为抗原刺激母体产生抗hCG抗体(anti-hCG antibody,AhCGAb)。曾有报道在做试管婴儿时大量应用绒毛膜促性腺激素,在血液中测不到绒毛膜促性腺激素,或含量极低,经研究后发现患者体内存在抗绒毛膜促性腺激素抗体,使外用绒毛膜促性腺激素进入体内不敏感,从而导致治疗用量无效。在接受过hCG注射以治疗功能性子宫出血或促进排卵的妇女中,其体内的抗hCG抗体也有可能为阳性,患者可在临床上表现为不孕或习惯性流产。另有动物实验证实,保护胎儿免受母体淋巴细胞的排斥反应主要是通过抑制抗hCG抗体来实现的,若这种抑制被减弱,导致抗体含量增加,则这种保护作用将受到破坏,从而引起不孕。
七、抗滋养层细胞膜抗体及其检验诊断
胎儿具有来自父方和母方的基因。对孕妇而言,胎儿是一个半非己的同种异体移植物。正常妊娠时胎儿不被母体排斥,主要依赖于母体对胎儿特殊的免疫调节,这种调节可以制止或改变对胚胎不利的免疫因素,以达到新的免疫平衡。胚胎的外层即合体滋养层是直接与母体循环相接触的部分,免疫组化证实合体滋养层不表达任何HLA或ABO血型抗原,这点被认为是确保胎儿成活的一种保护性机制之一,但是合体滋养层浆膜上有可被母体识别的抗原系统。至于这些抗原的性质尚无统一定论,但它们的存在,影响着孕妇与胎儿之间的免疫平衡。
目前有学者认为,在滋养层表面存在有滋养叶淋巴细胞交叉反应抗原(trophoblast-lymphocyte cross reactive antigen ,TLXAg),它是一种同种异型抗原,可产生保护性的封闭抗体,可以通过与胎儿-胎盘滋养叶抗原结合或与母体淋巴细胞结合,防止胚胎或胎儿父系抗原被母体免疫系统识别和杀伤。如果TLX抗原抗体减少,即可使胎儿细胞特异性抗原暴露,导致免疫性流产的发生。
抗滋养层细胞膜抗体(trophoblast antigen ,TA)的检测可作为反复流产患者的免疫因素辅助诊断指标。由于TLXAg是正常妊娠时合体滋养层存在的抗原,因此对其抗体水平的检测很难作出一个有意义的判定。而滋养细胞膜特异性抗体可以准确地检测,且研究已证实抗滋养层细胞膜抗体与那些具有自身免疫倾向的妇女血中可能存在的抗磷脂抗体、抗核抗体等不存在交叉反应。研究表明在不明原因流产的妇女血清中,抗滋养层细胞膜抗体比正常孕妇明显增高,这种抗体的增高与流产之间有着密切联系,很可能是导致流产的主要因素之一。正常孕妇血清抗滋养细胞膜抗原的水平很低,当其水平达到一定高的程度时,即有可能引起较强的抗原抗体反应,从而导致流产。其机制可能与封闭抗体的减少有关。不过这方面的报道国内尚不多见。
参考文献
1 张建平,余裕炉,焦保权,等.不孕不育妇女四项自身免疫抗体的研究. 中国优生与遗传杂志, 2003,11(5):135
2 龚世王旬,纪树芳,王辉,等.生殖免疫检测在不孕不育中的临床应用. 中国优生与遗传杂志,2003,11(2):95~96
3 李笑梅,陈永华,汤明礼,等.不孕妇抗精子抗体和抗子宫内膜抗体的检测. 临床检验杂志,1999,17( 3):181
4 黄邱朝,王国洪.不孕症妇女抗卵巢抗体与血清激素水平的关系. 上海医学,1997,10(20):573
5 希乐,王为服,邵公权,等.子宫内膜异位症致不孕的机理探讨. 生殖与避孕,1996,16(4):268
6 Bohring C, Krause W. The role of antisperm antibodies during fertilization and for immunological infertility J. Chem Immunol Allergy,2005;88:15~26
7 Bohring C, Klepper L, Krause W. Localization of binding sites of naturally occurring antisperm antibodies on human spermatozoa by immunofluorescence, Andrologia. 2004,36(5):286~290
8 Domagala A, Kurpisz M. Immunoprecipitation of sperm and somatic antigens with antibodies from sera of sperm-sensitized and anti-sperm antibody-free individuals. Am J Reprod Immunol. 2004,51(3):226~234
9 Forges T, Monnier-Barbarino P, Faure GC, Bene MC. Autoimmunity and antigenic targets in ovarian pathology,Hum Reprod Update. 2004 ,10(2):163~175
10 Chiu WW, Erikson EK, Sole CA, Shelling AN, Chamley LW. SPRASA, a novel sperm protein involved in immune-mediated infertility,Hum Reprod. 2004 ,19(2):243~249
11 Hatasaka H. Immunologic factors in infertility J . Clin Obstet Gynecol ,2000 , 43 (4) :830~843
12 Shibahara H , Hirano Y, Takamizawa S , et al . Effect of sperm mobilizing antibodies bound to the surface of ejaculated human spermatozoa on sperm motility in immunologically infertile men J . Fertil Steril , 2003 , 79(3) :641~642
13 Sakin2Kaindl F , Wagenknecht DR , Strowitzki T , et al . Decreased suppression of antibody-dependent cellular cytotoxicity by seminal plasma in unexplained infertility J . Fertil Steril , 2001 , 75 (3) :581~587
14 Korotkova IV , Nikolaeva MA , Bozhedomov VA , et al . Free radical generation in ejaculate samples from infertile patients J . Bull Exp Biol Med , 2001 , 131 (6) :555~557
15 Myogo K, Yamano S , Nakagawa K, et al . Sperm2immobilizing antibodies block capacitation in human spermatozoa J . Arch Androl ,2001 , 47 (2) :135~142
16 Ni J , Li QL , Zhang W, et al . Changes in soluble interleukin-2 receptor level in serum and Na +-K+- exchanging ATPase activity in semen of infertile men caused by antisperm antibody J . Asian J An drol , 2000 , 2 (2) : 151~153
|